Nachts sind alle Nebel grau
Eine astronomische Sicht auf die Physiologie des Sehens

| Grundlegendes | Dunkeladaption | Stäbchen vs. Zapfen |
|
Nachts sind alle Nebel grau Eine astronomische Sicht auf die Physiologie des Sehens |
 |
Über den Sehprozess und speziell die Dunkel- und Lichtadaption im Zusammenhang mit der Deep-Sky-Beobachtung kursieren auf den diversen Astroforen und Webseiten die wildesten Theorien. Wie passiert genau mit dem Rhodopsin? Wie funktioniert das Sehen bei Nacht? Was ist eigentlich Dunkeladaption und warum dauert sie so lange? Und was hat das Ganze mit Rotlicht zu tun?
Während meiner Zeit an der Uni Freiburg habe ich zehn Jahre als Biophysiker mit spektroskopischen Methoden über die Aktivierung und Deaktivierung des Rhodopsin geforscht (hier meine Publikationsliste aus der Zeit). Für das Deep Sky Meeting 2012 habe ich die Themen, die für uns Amateurastronomen am wichtigsten sind, in einem Vortrag zusammen gefasst. In den folgenden drei Teilen stelle ich das Wichtigste daraus noch einmal vor.
Teil 1
Grundlegendes zum Sehen
| Aufbau der
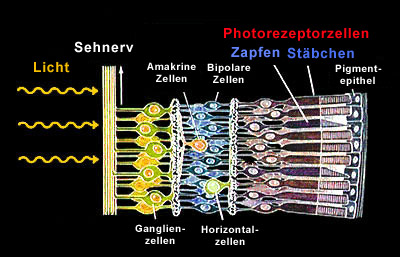
Netzhaut In der Netzhaut unseres Auges besitzen wir zwei Typen von Photorezeptorzellen, die so genannten Stäbchen (rod cells) und die Zapfen (cone cells). Anders als man dies landläufig vermutet, sitzen diese Zellen auf der Rückseite der Netzhaut, so dass das Licht zunächst mehrere Schichten aus Nervenzellen durchqueren muss, bevor es auf die eigentlich lichtempfindlichen Zellen trifft.
|
 |
|
Drei Typen Zapfen, ein Typ
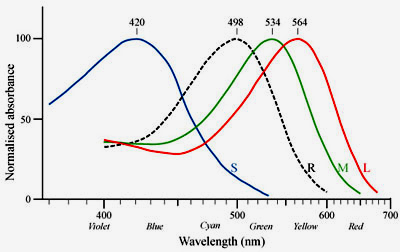
Stäbchen Diese Photorezeptorzellen unterscheiden zunächst einmal aufgrund ihrer spektralen Empfindlichkeiten. Von den Stäbchenzellen (rods, R) gibt es nur einen Typ, der für das Nachtsehen (skotopisches Sehen) zuständig ist und die maximale Empfindlichkeit im Grünen hat. Von den Zapfen (cones) gibt es drei Typen, S (blau), M (grün) und L (rot), die für das Farbensehen bei Helligkeit (photopisch) zuständig sind. |
| Aufbau
der Stäbchenzelle Schauen wir uns einmal den Aufbau einer Stäbchen-Zelle genauer an. Sie bestehen aus einem Innensegmente mit dem Zellkern und einem Außensegment. Die Außensegmente enthalten in ihrem Inneren einen Stapel aus flachen Membranvesikeln, die Diskmembranen genannt werden. |
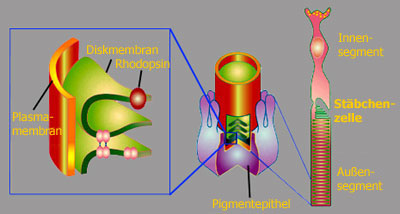 |
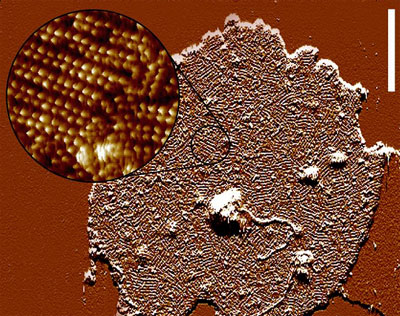
Diese Diskmembranen sind dicht gepackt mit dem eigentlichen Photorezeptor, Rhodopsin. Die Aufnahme rechts wurde mit Atomic-Force-Mikroskopie erhalten und gibt einen guten Eindruck von der Rezeptordichte in der Membran (jeder Hubbel entspricht einem Rhodopsin). Die quasikristalline Struktur, die hier angedeutet ist (Fotiadis et al. (2003) Nature 421:127), ist sehr wahrscheinlich ein Präparationsartefakt und entspricht nicht der Situation in der Photorezeptorzelle in vivo, in der die Rotationsdiffusion von Rhodopsin kaum eingeschränkt ist. Die Stapelung der Diskmembranen und die hohe Rezeptordichte in ihnen stellen eine Optimierung dar, um möglichst viele der eintreffenden Photonen einzufangen. |
 |
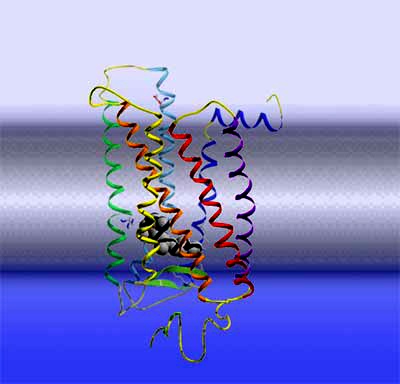 |
Rhodopsin Hier gehen wir noch eine Stufe tiefer und sehen ein molekulares Modell des eigentlichen Lichtrezeptors Rhodopsin, ein Membranprotein. Rhodopsin besteht aus 7 sogenannten α-Helices, die die Diskmembran durchspannen. Rhodopsin gehört zu einer wichtigen Klasse von Membranrezeptoren, den sogenannten G Protein-gekoppelten Rezeptoren. Man schätzt, dass etwa 50% aller eingesetzten Pharmaka auf Rezeptoren dieser Familie abzielen. Von daher ist die Erforschung ihrer Struktur und Funktionsweise momentan ein ganz großes Thema in den Life Sciences. So gehören die Rezeptoren für Adrenalin, Dopamin, weitere Neurotransmitter, eine Vielzahl von Hormonen, Geruchsstoffen, etc. zu dieser Rezeptorfamilie. Sobald die Rezeptoren ihren spezifischen Liganden außerhalb der Zelle binden, werden sie aktiviert und setzten im Zellinneren eine Signalkette in Gang. Übrigens wurde der Nobelpreis 2012 für Chemie an Robert Lefkowitz und Brian Kobilka verliehen, die bahnbrechnende Arbeiten zu diesem Typ von Rezeptoren geleistet haben.
|
|
Rhodopsin-Aktivierung Rhodopsin ist in ein recht spezielles Mitglied dieser Rezeptorfamilie, da es seinen Liganden, Retinal schon gebunden hat. Retinal ist ein Vitamin A-Derivat und als geknicktes 11-cis-Isomer als protonierte Retinal-Schiff-Base kovalent im Rezeptor gebunden. Durch seine spezielle elektronische Struktur absorbiert es bei 500nm (bei Menschen etwas langwelliger). Absorbiert es ein Photon, so wandelt es in einer der schnellsten (200fs) und effizientesten (67% Quantenausbeute) photochemischen Reaktionen überhaupt in die all-trans-Form um. |
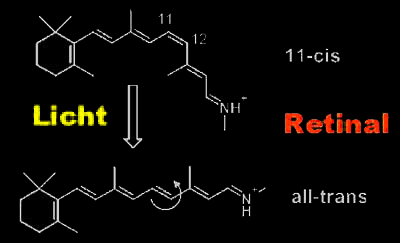 |
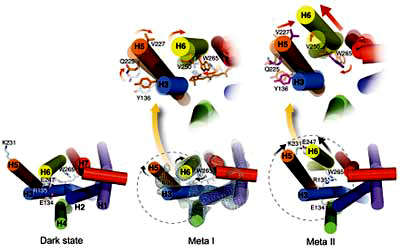 Ye et al. and Vogel (2010) Nature 464:1386
|
Was dann passiert, ist ziemlich komplex. Das gestreckte all-trans-Retinal passt nicht mehr in seine alte Bindungstasche und zwingt das Rezeptorprotein in seine aktivierte Konformation. Dies geht nicht auf einmal, sondern über eine Reihe von Schritten, sogenannte Intermediate, bei denen sich der Rezeptor auf verschiedenen Hierarchiestufen verändert. Dabei drehen und verschieben sich zunächst Seitenketten einzelner Aminosäuren, später ganze α-Helices. Mit diesen Bewegungen einhergehend ist auch das Aufbrechen und die Neubildung von elektrostratischen Wechselwirkungen zwischen geladenen Gruppen innerhalb des Proteins bzw. deren Neutralisierung durch Protonenaufnahme. Die dabei entstehenden Intermediate heißen Batho, BSI, Lumi, Meta I und schließlich Meta II. |
| G
Protein-Aktivierungskaskade Der Meta-II-Zustand entspricht der aktiven Rezeptorkonformation R*. Durch die initialen Veränderungen in der der Retinalbindungstasche hat sich schließlich die cytoplasmatische Seite des Rezeptors umgestaltet, so dass der Rezeptor nun in der Lage ist, ein so genanntes G Protein zu binden und in diesem einen Nukleotidaustausch zu bewirken, wodurch diese selbst aktiviert wird. Das aktivierte G Protein verlässt den Rezeptor und macht den Platz frei für weitere, die wiederum aktiviert werden. Die aktivierten G Proteine wiederum binden an weitere, nachgeschaltete Komponenten der Aktivierungskaskade. |
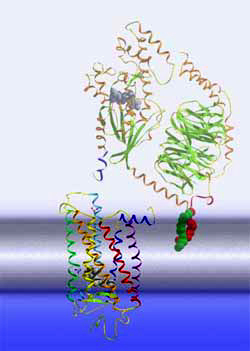 |
| Eines der wichtigen
Ziele bei der Signaltransduktion ist ein hohes Signal-zu-Rausch-Verhältnis.
Das heißt ein möglichst großes Signal bei möglichst wenig Rauschen.
Ein hohes Signal wird erreicht durch:
Ein niedriges Rauschen wiederum wird erreicht durch:
|
Weiter zu Dunkeladaption: Was passiert in unserem Auge, wenn es dunkel wird?
![]()
| Grundlegendes | Dunkeladaption | Stäbchen vs. Zapfen |